破局:无痛生存大幅提升6个月!这种可穿戴的治疗给癌症“王中王”治疗带来曙光
“万病之王”的癌症一直是威胁人类健康的重大疾病,其中胰腺癌因其极低的生存率被称为 “癌中之王”。今天,我们带来一则令人振奋的消息,Novocure公司的肿瘤电场治疗(TTFields)疗法在胰腺癌治疗上取得了重大进展,下面就为大家详细解读。
在正在召开的2025年ASCO会议上,Novocure 公司更新了 3 期PANOVA-3 临床试验的数据,显示该试验成功达到了总生存期(主要终点)和无疼痛生存期(次要终点),为胰腺癌患者带来了新的希望。
PANOVA-3试验评估的是肿瘤电场治疗(TTFields,150 kHz)疗法与吉西他滨(gemcitabine)+白蛋白紫杉醇(nab-paclitaxel)的联合使用,作为不可切除的局部晚期胰腺癌的一线治疗方法。对照治疗方案为目前临床上的标准化疗方案:吉西他滨+白蛋白紫杉醇 (GnP)。
最新的结果显示,与现有的GnP一线治疗方案相比,TTFields联合治疗在多个研究终点上取得了统计学上的显著改善[1]:
总生存期:TTFields联合治疗的中位生存期为16.2个月,GnP组为14.2个月,TTFields 联合治疗将死亡风险降低18% (HR = 0.82, 95% CI, 0.68 - 0.99; p = 0.039)
无疼痛生存期:TTFields 联合治疗组患者中位无疼痛生存期为15.2个月,相比之下,GnP组为9.1个月,疼痛加重或死亡风险降低26% (HR = 0.74,95% CI: 0.56 - 0.97,p = 0.027)
远处无进展生存期:TTFields 联合治疗组患者中位远处无进展生存期为 13.9 个月 ,相比之下,GnP组为11.5 个月,远处转移或死亡风险降低26% (HR = 0.74,95% CI: 0.57 - 0.96,p = 0.022)

图:在意向治疗人群(ITT)中,TTFields联合治疗使中位总生存时间显著延长 2.0 个月。在修正意向治疗人群(mITT)中,TTFields 联合治疗较单纯化疗展现出更显著的中位总生存改善(18.3个月 vs 15.1 个月,P = 0.023)。通常而言,mITT 人群较 ITT 人群更能真实反映治疗效果,这是由于ITT 人群中有部分受试者在首个治疗周期内就离组了,且大部分离组原因为非疾病进展 / 死亡(如患者撤回了临床试验知情同意)。mITT人数虽然减少了,但是参试者都至少完成首个治疗周期。
总生存数据在之前的会议中已经被报道过,但无疼痛生存期数据是第一次报道,值得关注。
对于肿瘤患者来说,单纯的生存数据只是冰冷的统计数字,它机械地记录着生命的长度,却无法衡量生命的质量与温度。
比生存更重要的,是有尊严的生存。无疼痛生存指标的意义,不仅仅是生存,而且是对疼痛的把控,也即是有尊严的生存,它饱含着对患者身心的深切关怀,是对生命尊严的守护。
如今的结果表明,使用TTFields联合治疗之后,患者的无疼痛生存期延长了6.1 个月,在某种意义上,这比仅仅是生存时间增加了6个月更有意义!
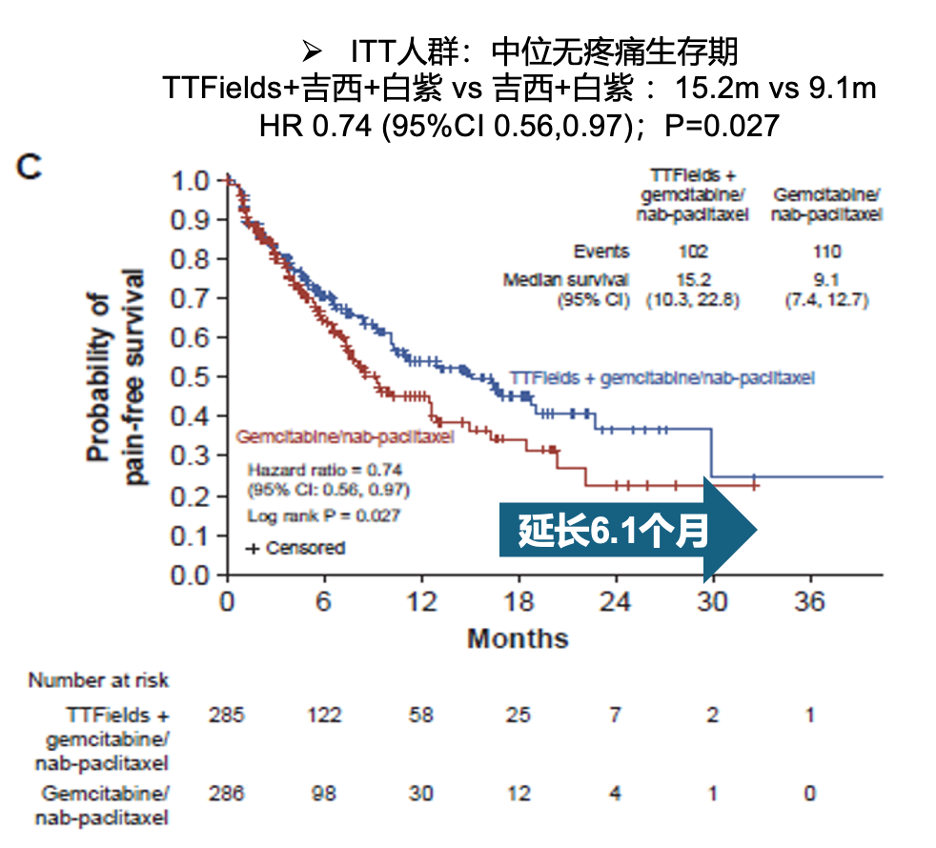
图:无疼痛生存获益。
无痛生存的患者,不必在剧痛中消耗意志,更能以平和的状态感受生活、拥抱家人,重拾对生命的掌控感。
(注:无疼痛生存期定义为从基线开始,至患者在疼痛视觉量表上报告疼痛增加 20 分及以上,或直至死亡的时间)。
胰腺癌是最致命的癌症之一,是美国癌症死亡的第三大常见原因。虽然总体癌症发病率和死亡率保持稳定或下降,但胰腺癌的发病率和死亡率却在上升。据估计,美国每年约有 67,000 名患者被诊断患有胰腺癌,而中国则有11.9万人[2]。
医生通常根据疾病的阶段,使用手术、放疗和药物疗法的不同组合来治疗胰腺癌。对于局限性胰腺癌患者,治疗标准是手术,然后是化疗±放疗。然而,大多数局部晚期病例虽然未扩散到远处器官,但因肿瘤严重包绕周围关键的动静脉血管结构而无法手术切除,此时通常只能选择化疗联合或不联合放疗作为唯一的治疗方案。
对于这样的局部进展期胰腺癌(LAPC)患者,生存预后非常不乐观,生存期通常只有9-16 个月(取决于转化治疗后肿瘤的可切除性),5 年生存率仅 5%。
不仅如此,即便是接受常规治疗,可用的治疗手段有限,而且常伴随生存质量(QoL)下降及毒性负担。
同时,目前正在进行的关于LAPC的临床研究也较少,除PANOVA-3以外,均为 2期临床试验。之前虽然开展过一些3期试验,但都以失败告终[3]。
在PANOVA-3研究中,总生存获益的P 值为0.039,支持研究结果的统计学上的显著性。无疼痛生存的显著提高,也直击了癌症治疗的痛点。PANOVA-3试验的结果,支持TTFields作为无法手术的LAPC患者治疗的新标准。
TTFields的常见副作用,主要为局部的皮肤过敏。
TTFields提高生存期的一小步,是人类战胜胰腺癌的一大步!
在癌细胞的分裂、繁殖过程中,细胞的染色质浓缩以后形成染色体,然后需要正确排列到母细胞的中间,再依靠微管蛋白均匀地平分给两个子细胞。由于染色体、微管蛋白都是带电荷的,如果有交变电场的存在,就会干扰它们的正确排列,影响细胞分裂的进行。
由于癌细胞与正常细胞在细胞分裂过程中存在差异,TTFields 所产生的交变电场可以特异性针对癌细胞,而对正常细胞不产生显著影响。
而一但癌细胞的分裂出了错误,分裂后的子细胞就变成了“废品”。这些“废品”细胞的归途,就是死亡。
肿瘤电场治疗如同在癌细胞分裂的齿轮中投入扳手——通过物理干预书写新的抗癌规则!
TTFields在阻断微管蛋白组装、干扰肿瘤细胞有丝分裂的同时,也会增强紫杉醇药物敏感性。TTFields与化疗药物联用,可以实现对癌细胞的物理-化学双重打击。
在PANOVA-3研究中,与化疗相比,TTFields联合治疗虽然显示了对无进展生存期(PFS)提高的趋势,但是差异无统计学意义。同样,对于局部PFS,联合治疗也仅是显示了出了获益趋势。
相比之下,对于远处PFS这个指标,联合治疗却是显示出来了明显的提高。
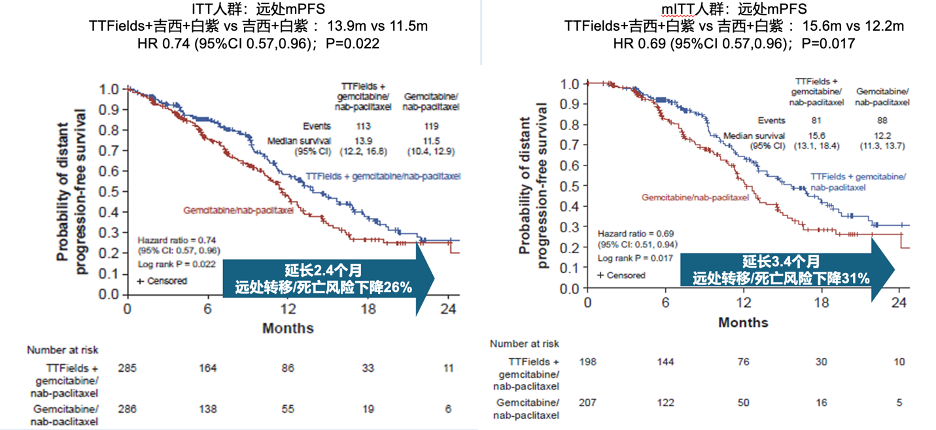
图:远处无进展生存获益。在mITT人群中,TTFields联合治疗所带来的获益更明显。
一般来说,癌症治疗需要先显示出明显的PFS优势,才能转化成OS的优势,但是PANOVA-3的数据告诉我们,TTFields联合治疗带来的总生存获益,应该是来自电场对于胰腺癌细胞远端转移能力的打击!
癌王也不愧是癌王,在自己的“根据地”里(局部),其抗打击能力还是很强的。
但当物理电场撞上化疗药物,癌王的铜墙铁壁终于被撕开裂隙!至少胰腺癌远端扩散、转移的能力受到了限制,从而带来了总生存、无疼痛生存等指标的显著获益!
还需要指出的是,在PANOVA-3研究中,联合治疗患者中有3人获得了完全缓解(CR),化疗组无一人获得完全缓解。虽然由于数量比较小,两组数据在统计分析中没有显著差异,但这也是LAPC治疗的一道光!而这道光,就是来自被TTFields 撕破的铜墙铁壁。
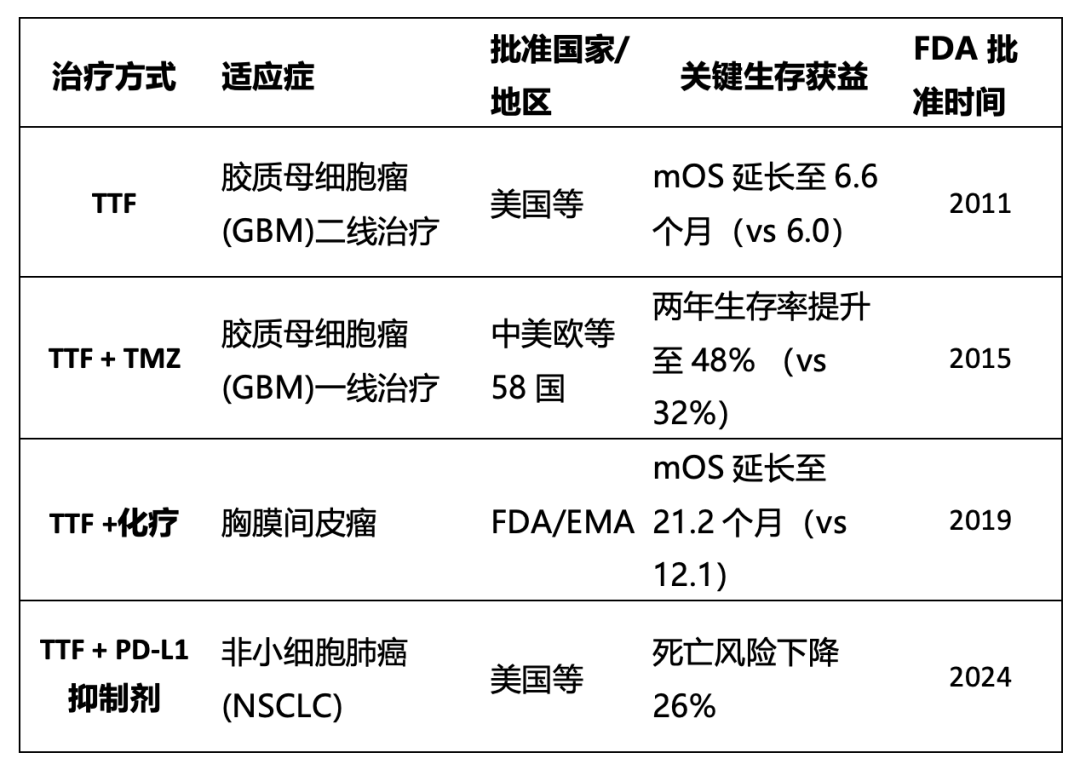
除了在胰腺癌治疗上的突破,TTFields疗法已在某些国家获批用于治疗多种癌症。其商业化产品已被批准用于治疗患有胶质母细胞瘤、恶性胸膜间皮瘤和胸膜间皮瘤、非小细胞肺癌的患者。此外,Novocure还有多项正在进行或已完成的临床试验,探索 TTFields 疗法在更多癌症治疗中的应用。
当化疗遇见电场,生存不再是偶然——物理与化学的共舞,正为"癌王"患者点亮生命延长线!
如果你觉得这篇文章对你有帮助,欢迎分享给身边的人,让更多人了解癌症治疗的新进展。也欢迎在评论区留言,分享你的看法和观点。
参考文献
1. Babiker, H.M., et al., Tumor Treating Fields With Gemcitabine and Nab-Paclitaxel for Locally Advanced Pancreatic Adenocarcinoma: Randomized, Open-Label, Pivotal Phase III PANOVA-3 Study. Journal of Clinical Oncology.0(0): p. JCO-25-00746.
2. Han, B., et al., Cancer incidence and mortality in China, 2022. J Natl Cancer Cent, 2024. 4(1): p. 47-53.
3. Picozzi, V.J., et al., LAPIS: Randomized phase 3 trial of chemotherapy (CTX) with and without pamrevlumab (PAM) for locally advanced pancreatic cancer (LAPC). Journal of Clinical Oncology, 2025. 43(4_suppl): p. 675-675.
4. Fabian, D., et al., Treatment of Glioblastoma (GBM) with the Addition of Tumor-Treating Fields (TTF): A Review. Cancers (Basel), 2019. 11(2).
发表评论







暂时没有评论,来抢沙发吧~